














原子序數相同,質量數不同的核素仍屬同一種元素,稱為同位素。
同位素由元素符號加上質量數區分,例如碳 12 和碳 14。
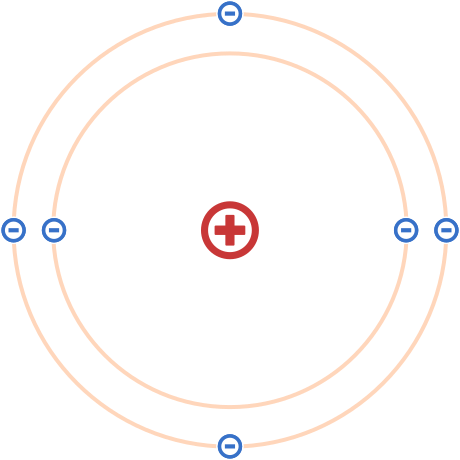
原子序數即原子核內含有質子的數目。不同的原子序數對應不同的元素。
原子序數亦決定了原子核外電子的數目,由此決定了元素的化學性質。
質量數為原子核內質子數與中子數之和。由於質子和中子質量相當,而電子質量相對輕微,原子的質量大致為一個質子質量的 \(A\) 倍。
中子數目等於 \(A-Z\)。
具有特定原子序數和質量數的原子核稱為核素。核素可以用符號 \(\,^{A}_{Z}X\) 來表示,\(X\) 為元素符號。
原子序數相同而質量數不同的核素,稱為同位素。同位素通常用元素符號加上質量數來區分表示。
同位素屬於同一元素,其原子核外的電子排布相同,所以化學性質相同。同位素的原子核卻可以有不同的物理性質,比如碳 12 沒有放射性,而碳 14 則具有放射性。